Acides Nucléiques
Études des propriétés biophysiques des nucléocapsides du VIH-1 et des interactions nucléocapsides-acides nucléiques
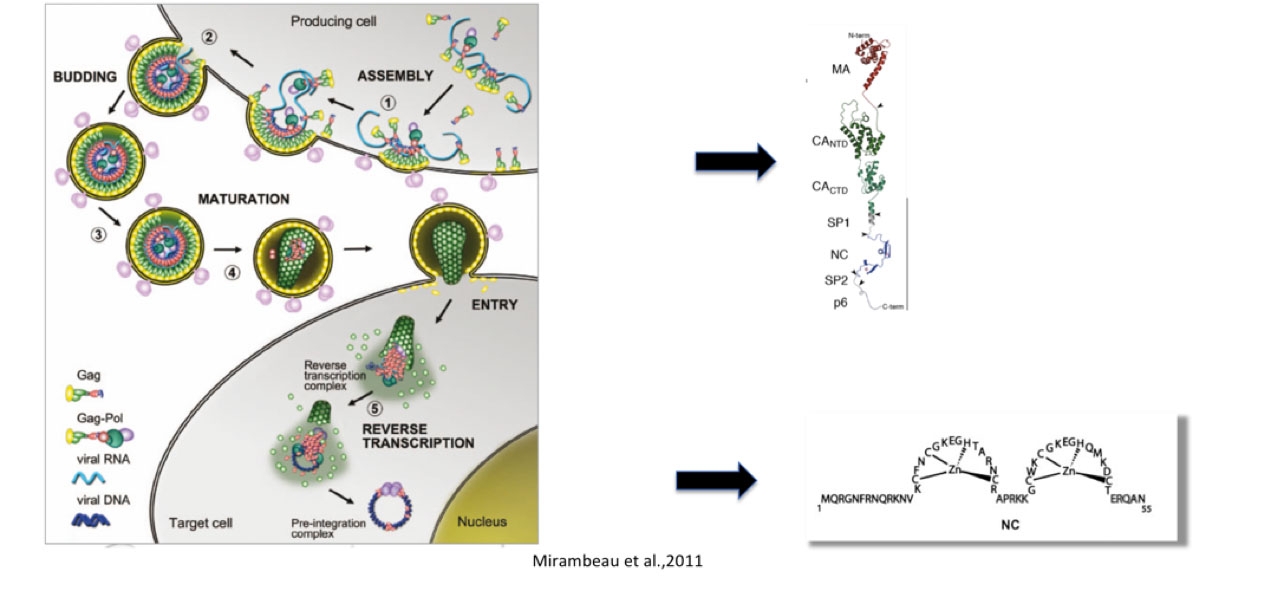
La protéine de nucléocapside (NCp7 ou domaine NC) est une petite protéine basique de 55 a.a. caractérisé par deux doigts de zinc très conservés et qui possèdent une très haute affinité pour le zinc. Chaque doigt de zinc constitue un plateau hydrophobe qui interagit fortement avec les bases des acides nucléiques (ADN et ARN) tandis que les autres portions de la protéine interagissent avec les acides nucléiques via des interactions de type électrostatique. La protéine de nucléocapside est une protéine flexible avec des parties désordonnées en N- et C-terminal et un court "linker" flexible relie les deux doigts de zinc. Cette protéine est le produit terminal du processus de maturation du précurseur Gag (55 kDa), qui est une protéine structurale majeure du VIH-1. Gag est impliqué dans l'assemblage, la maturation et le bourgeonnement de la particule virale, dans ce contexte le domaine NC est le domaine principal d'interaction de la protéine Gag avec les acides nucléiques, il a été montré qu'il est responsable de la sélection du génome viral non épissé parmi l'ensemble des ARN viraux et cellulaires présents dans le cytoplasme de la cellule infecté. La reconnaissance du génome viral se fait par l'intermédiaire de la reconnaissance du signal d'encapsidation, situé dans la partie 5' non traduite du génome, qui est une région particulièrement en structures secondaires.
La maturation du précurseur protéique commence au cours du processus de bourgeonnement de la particule virale et aboutit à la séparation physique des différents constituants du précurseur : matrice, capside et nucléocapside. Cette séparation permet au virus d'adopter sa structure mature nécessaire à l'infection des nouvelles cellules du système immunitaire. Lors de cette infection la protéine de nucléocapside recouvre le génome viral ARN qui se trouve protégé à l'intérieur de la capside virale. La nucléocapside, présente à ce stade sous sa forme maturée NCp7, a un rôle important lors de la transcription inverse aboutissant à la synthèse de l'ADN viral qui sera inséré dans le génome cellulaire au cours de l'étape d'intégration. Pendant la transcription inverse elle facilite les transferts de brin qui sont des étapes obligées de la transcription inverse. Au cours de ces transferts elle agit comme une protéine chaperon des acides nucléiques en facilitant les associations et les dissociations des acides nucléiques.
Dans l'équipe, nous utilisons des méthodes biophysiques (RMN, spectroscopies de fluorescence) et biochimiques pour obtenir de nouvelles informations sur ses modalités de fixation aux acides nucléiques.
Nous nous intéressons en particulier à:
- l'origine de la préférence de la nucléocapside pour des séquences particulières d'acides nucléiques (ADN ou ARN), de plus la protéine semble reconnaitre les séquences simple brin avec une polarité définie, nous cherchons à comprendre les bases moléculaires de cette préférence, le mode d'interaction du tryptophane (W37) avec les guanines apparait déterminant
- l'existence de plusieurs confirmations alternatives de la protéine qui possèdent des durées de vie importantes, ces conformations sont associées à une perte de coordination du zinc. Nous étudions leur rôle dans les interactions ARN-protéine et protéine-protéine dans le contexte des condensats macromoléculaires formés par les nucléocapsides. Ces condensats seraient des intermédiaires importants pour le processus d'encapsidation. Les informations sur ces conformations sont obtenues avec des méthodes RMN de type CPMG (Carr-Purcell-Meiboom-Gill), et CEST (Chemical Exchange Saturation Transfer).
- la dynamique intrinsèque de cette protéine semi-flexible qui a été evaluée en utilisant les temps de relaxation des spins 15N localisés dans le squelette protéique. La protéine présente une flexibilité importante dans certaines régions du linker ainsi que dans les parties terminales. L'interaction avec les acides nucléiques s'accompagne d'une réduction importante de la flexibilité de la protéine notamment dans ces zones flexibles.
- Enfin nous cherchons à comprendre les mécanismes qu'utilise la protéine pour déstabiliser les structures secondaires d'acides nucléiques, une fonction essentielle dans les transferts de brin se déroulant au sein de la transcription inverse.
Pour tout renseignement prière de contacter olivier.mauffret@ens-paris-saclay.fr tel 06 11 05 32 39
Tel Bureau 01 81 87 52 21