Développement de molécules photo-activables dans les processus de mort cellulaire
- Activités enzymatiques et processus biologiques déclenchés en cellules par excitation multiphotonique
L’équipe mène des recherches sur les applications de la microscopie multiphotonique et les effets photo-contrôlés de composés à absorption 2-photons ; nous étudions des molécules photo-activables capables de déclencher des processus biologiques et enzymatiques intracellulaires (apoptose cellulaire & photo-activation de la NO synthase (NOS)). Nous travaillons sur deux familles de composés fluorescents, toutes les deux compatibles avec une excitation proche infra-rouge (excitation 2-photons). La 1ère famille correspond à des activateurs de la NOS qui sont en fait des analogues photo-activables du NADPH. La 2nde famille, les triphénylamines, correspond à des composés qui ciblent à l’échelle subcellulaire des organelles (principalement les mitochondries) et déclenchent de façon strictement photo-dépendante l’apoptose cellulaire par production rapide et massive d’espèces réactives de l’oxygène (ROS).
- Transfert d’electron de la NO-synthase déclenché par la lumière
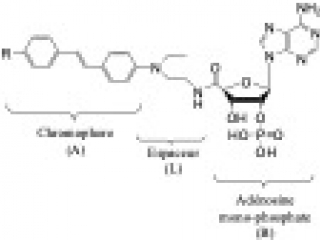
Nous étudions l’interaction entre la NO-synthase (NOS) et des analogues photo-activables du NADPH (le donneur naturel d’électron), basé sur la caractérisation d’un composé prototype activateur (nommé NT1) dont le transfert d’électron au sein de la NOS peut être photo-induit et qui présente des propriétés intéressantes d’absorption 2-photons (1-5) (en collaboration avec A. Slama-Schwok, Hôpital St Antoine et J. Xie, laboratoire de Chimie PPSM de l’ENS Paris-Saclay). Nous étudions également des dérivés inhibiteurs comme NS1 et avons été les premiers à développer un inhibiteur de la NOS ciblant son domaine réductase (6,7).
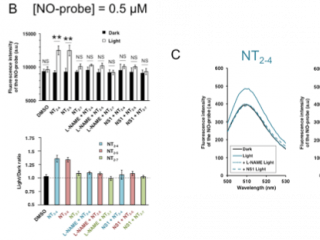
Nous avons montré que l’excitation lumineuse des composés NT par la lumière visible (excitation 1-photon) ou proche infra-rouge (excitation 2-photons) déclenche le transfert d’électron au sein de la NOS conduisant à la synthèse de NO et avons démontré leurs efficacités en milieu cellulaire.
La capacité à inhiber la concentration intracellulaire de NO par des composés de la famille NS peut être également appliqué au contexte de l’infection par le VIH-1, concernant notamment les concentrations de NO neurotoxiques, à l’origine de dysfonctions neuronales chez les patients infectés (démence associée au VIH). De telles concentrations de NO sont générées au niveau du neurone suite au relargage de protéines du VIH (Tat et/ou gp120/41) par les cellules infectées et qui aboutissent à la surproduction via l’activation NF-κB-dépendante de NOS inductible (iNOS) au niveau du neurone. A noter que l’implication de la NOS neuronale (nNOS) a également été reportée dans certaines situations mais semble jouer un rôle moins important que iNOS.
- Applications biologiques de l’excitation multiphotonique pour photo-induire la mort cellulaire : vers une thérapie photodynamique 2-photons
Le développement de composés pro-apoptotiques et de sondes d’imagerie optique capable d’imager l’apoptose représente un grand intérêt pour la thérapie et le diagnostic. La thérapie photodynamique (PDT) est une méthode de traitement basée sur l’administration de photosensibilisateurs (Ps). Ces molécules, lorsqu’elles sont excitées par une lumière de longueur d’onde appropriée, entraînent la formation d’espèces radicalaires de l’oxygène (ROS) qui induisent d’importants dommages cellulaires et conduisent à la mort cellulaire. Un point essentiel pour optimiser les traitements PDT concerne la voie d’excitation. Il y a en effet un réel besoin de nouveaux Ps dont l’activation soit compatible avec des longueurs d’onde optimales du point de vue de la pénétration tissulaire. Nous étudions en collaboration avec le laboratoire de M-P. Teulade-Fichou (Institut Curie-Orsay), des triphénylamines cationiques (TPA) ; nous avons montré qu’ils induisaient la mort cellulaire sous illumination 1- ou 2-photons et avons étudié leurs mécanismes de déclenchement photo-induit de l’apoptose cellulaire (8-11), dans le but à terme d’appliquer les TPA dans une approche thérapeutique type PDT, dans ce cas multiphotonique, pour le traitement des tumeurs.
Les TPAs ont des caractéristiques d’absorption 2-photons (non linéaire) intéressantes grâce à leur organisation quadri (2-branches) ou octupolaire (3-branches). A l’échelle subcellulaire, les TPA co-localisent avec des organelles avant illumination, et sont redirigés vers le noyau sous irradiation lumineuse (8,9). Nous avons réalisé une étude des relations structure-activité des TPAs (dont la structure varie à la fois par le nombre de branches (2 ou 3) ou leur nature chimique : N-methyl benzimidazolium (Bzim) ou pyridinium en position para (Py) ou ortho (Pyo)) qui a permis de montrer que c’était le nombre de branches qui conditionnait la localisation subcellulaire (mitochondries vs endosome tardif) ; la nature chimique des branches jouant un rôle mineur dans la localisation subcellulaire.
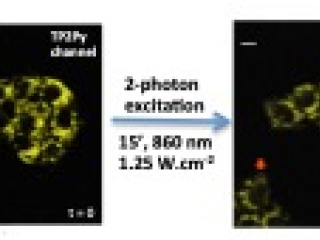
Structures d’un TPA 2-branches (TP2Py) et d’un TPA 3-branches (TP3Bzim) (A). (B) Imagerie de fluorescence de la production de ROS dans des cellules MCF7 prétraitées avec le TP2Py sous irradiation 2-photons.
Nous avons observé que les composées bi-branchés et tri-branchés induisaient tous principalement un phénomène d’apoptose cellulaire post-irradiation, mais les composés 2-branches impliquaient aussi un phénomène nécrotique propre distinct de l’apoptose tardive (9,11). La différence de mécanisme de mort cellulaire des deux familles est liée à une localisation subcellulaire initiale différente (avant irradiation) ainsi qu’à une différence de mécanismes d’internalisation qui sont différents entre les composés 2- et 3-branches (11). Les composés des deux familles sont internalisés par un mécanisme actif d’endocytose mais, tandis que les TPA 2-branches sont internalisés par un mécanisme clathrine-dépendant, les TPA 3-branches sont internalisés par une voie clatrine indépendante (cavéoline-dépendante). Le nombre de branches conditionne le destin intracellulaire des TPA et par voie de conséquence le(s) mécanisme(s) de mort cellulaire impliqué(s).
1. Beaumont E., Lambry JC., Blanchard-Desce M., Martasek P., Panda S.P., van Faassen E.E., Brochon JC., Deprez E. & Slama-Schwok A. NO formation by neuronal NO-synthase can be controlled by ultrafast electron injection from a nanotrigger. Chembiochem (2009) 10, 690-701.
2. Nguyen NH., Bogliotti N., Chennoufi R., Henry E., Tauc P., Salas E., Roman LJ., Slama-Schwok A., Deprez E. & Xie J. Convergent synthesis and properties of novel photoactive NADPH mimics targeting nitric oxide synthases. Org. Biomol. Chem. (2016) 14, 9519-9532.
3. Dilly S., Roman L.J., Bogliotti N., Xie J., Deprez E. & and Slama-Schwok A. Design of Light-Sensitive Triggers for Endothelial NO-Synthase Activation. Antioxidants (2020) 9:89.
4. Chennoufi R., Cabrié A., Nguyen N. H., Bogliotti N., Simon F., Cinquin B., Tauc P., Boucher J-L., Slama-Schwok A., Xie J. & Deprez E. Light-induced formation of NO in endothelial cells by photoactivatable NADPH analogues targeting nitric-oxide synthase. BBA-General subjects (2019) 1863, 1127-1137.
5. Polese C., Deprez E., Tauc P., Bogliotti N. & Xie J. Synthesis and Spectroscopic Characterization of Novel Thiourea-Bearing Photoactivatable NADPH Mimics Targeting NO Synthases. Synthesis (2022) 54(10), 2447-2456.
6. Li Y.†, Wang H.†, Tarus B., Romero Perez M., Morellato L., Henry E., Berka V., Tsai A.L., Ramassamy B., Dhimane H., Dessy C., Tauc P., Boucher J-L., Deprez E.‡§, Slama-Schwok A.‡§ Rational design of a fluorescent NADPH derivative imaging constitutive nitric-oxide synthases upon two-photon excitation. Proc. Natl. Acad. Sci. U.S.A (2012) 109, 12526-31.
7. Rouaud F., Romero-Perez M., Wang H., Lobysheva I., Ramassamy B., Henry E., Tauc P., Giacchero D., Boucher JL., Deprez E., Rocchi S.†, Slama-Schwok A.† Regulation of NADPH-dependent Nitric Oxide and reactive oxygen species signalling in endothelial and melanoma cells by a photoactive NADPH analogue. [†co-corresponding authors] Oncotarget (2014) 5, 10650-64.
8. Chennoufi R.†, Bougherara H.†, Gagey-Eilstein N., Dumat B., Henry H., Subra F., Mahuteau-Betzer F., Tauc P., Teulade-Fichou MP. & Deprez E. Differential Behaviour of Cationic Triphenylamine Derivatives In Fixed and Living Cells. Chem. Commun. (2015) 51, 14881-14884.
9. Chennoufi R., Bougherara H., Gagey-Eilstein N., Dumat B., Henry H., Subra F., Bury-Moné S., Mahuteau-Betzer F., Tauc P., Teulade-Fichou MP. & Deprez E. Mitochondria-targeted Triphenylamine Derivatives Activatable by Two-Photon Excitation for Triggering and Imaging Cell Apoptosis. Sci. Rep. (2016) 6:21458.
10. Fourmois L., Poyer F., Sourdon A., Naud-Martin D., Nagarajan S., Chennoufi R., Deprez E., Teulade-Fichou M-P. & Mahuteau-Betzer F. Modulation of Cellular Fate of Vinyl Triarylamines through Structural Fine Tuning: To Stay or Not To Stay in the Mitochondria? ChemBioChem (2021) 22, 2457-2467.
11. Chennoufi R., Trinh N-D., Simon F., Bordeau G., Naud-Martin D., Moussaron A., Cinquin B., Bougherara H., Rambaud B., Tauc P., Frochot C., Teulade-Fichou M-P., Mahuteau-Betzer F. & Deprez E. Interplay between Cellular Uptake, Intracellular Localization and the Cell Death Mechanism in Triphenylamine-Mediated Photoinduced Cell Death. Sci. Rep. (2020) 10:6881.